2019新型冠狀病毒核酸檢測試劑注冊技術審評要點
| 關于發布《2019新型冠狀病毒核酸檢測試劑注冊技術審評要點》的通告(2020年第4號) |
| 2020-02-12 17:00 |
|
為應對新型冠狀病毒感染的肺炎疫情,按照“統一指揮、早期介入、隨到隨審、科學審批”的原則和確保產品安全、有效、質量可控的要求,我中心制定了《2019新型冠狀病毒核酸檢測試劑注冊技術審評要點》,現予以發布。 附件:2019新型冠狀病毒核酸檢測試劑注冊技術審評要點(下載)
國家藥品監督管理局 |
遺傳辦國際合作臨床試驗備案程序
中國人類遺傳資源國際合作臨床試驗備案程序
若樣本例數大于500例,則需要進行采集審批,采集審批完成后才能進行國際合作臨床試驗備案,備案材料提交成功,獲得備案號后即可開展試驗。
所需時間:材料合格即可有備案號。
填報單位:申辦方或醫療機構(組長單位)
| 序號 | 提交材料名稱 |
資料 類型 |
要求 |
| 1 | 備案信息表 | 電子 |
合作單位簽章頁簽字蓋章。 網上填寫后生成。 |
| 2 |
法人資格材料 (申辦方、CRO、醫療機構均需要) |
電子 |
法人資格材料包括企業法人營業執照或事業單位法人證書或民辦非企業單位登記證書等。 醫療機構僅上傳組長單位的材料。 |
| 3 | 知情同意書文本 | 電子 | 無 |
| 4 | 倫理審查批件 | 電子 | 多中心臨床試驗的參與合作醫療機構的倫理審查批件可以與組長單位同時提交,也可以在組長單位備案成功后提交。 |
| 5 | 研究方案 | 電子 | 無 |
| 6 | 國際合作協議 | 電子 |
簽字蓋章(終版)。 協議應為中文版本的協議。 |
| 10 | 承諾書 | 電子 | 簽字蓋章,參與醫療機構提供。 |
遺傳辦采集審批相關事項
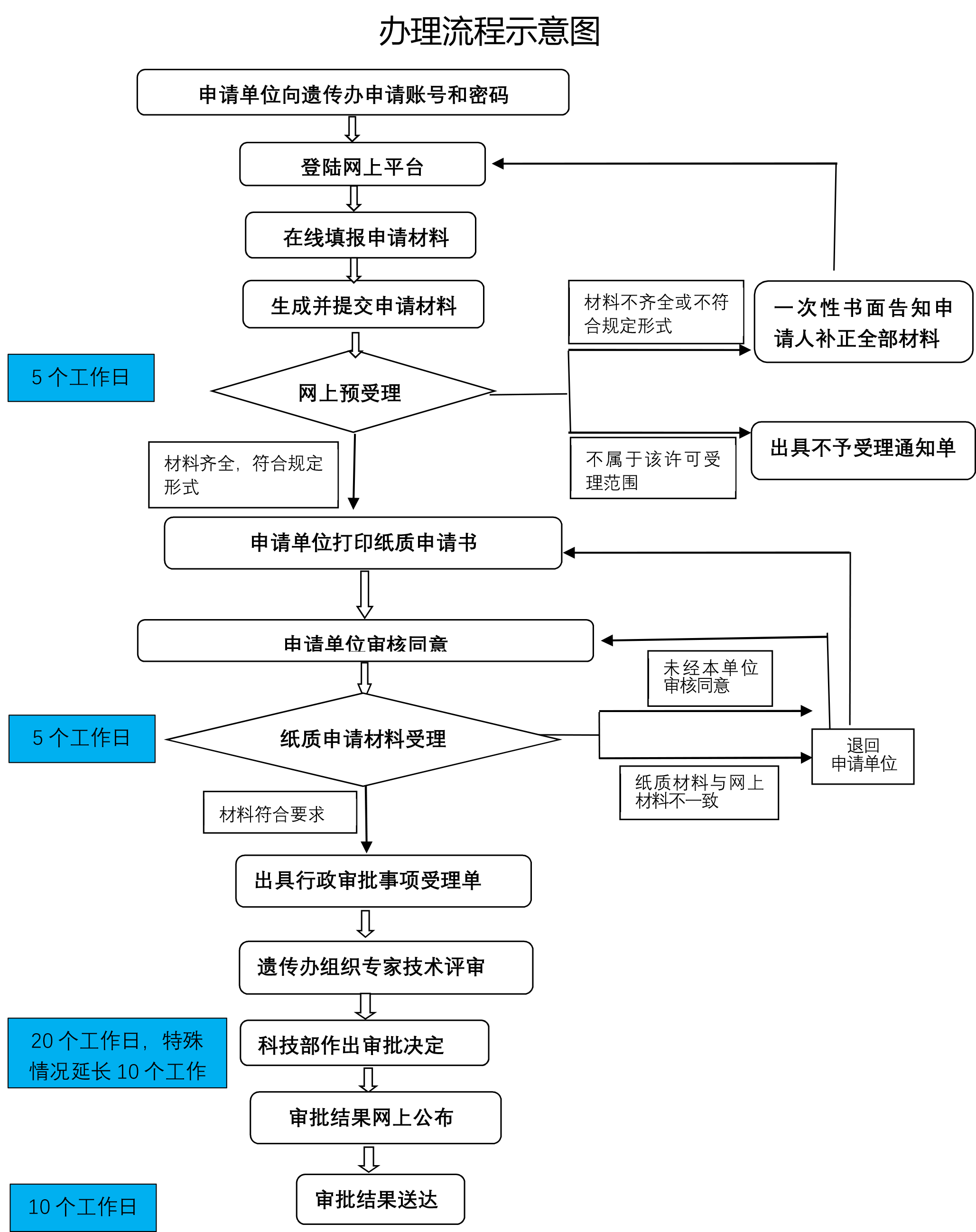
| 序號 | 提交材料名稱 | 原件/復印件 | 份數 | 紙質/電子 | 要求 |
| 1 | 申請書 | 原件 | 1 | 紙質和電子 | 網上平臺填寫后,紙質蓋章提交。 |
| 2 | 法人資格材料(申辦方、CRO、機構) | 復印件 | 1 | 紙質和電子 |
法人資格材料包括: 企業法人營業執照 或事業單位法人證 或民辦非企業單位登記證書等。 |
| 3 | 知情同意書文本 | 復印件 | 1 | 紙質和電子 | 無 |
| 4 | 倫理審查批件 | 復印件 | 1 | 紙質和電子 | 無 |
| 5 | 采集方案 | 復印件 | 1 | 紙質和電子 | 無 |
| 6 | 人類遺傳資源管理制度 | 復印件 | 1 | 紙質和電子 | 無 |
| 7 | 合作協議文本 | 復印件 | 1 | 紙質和電子 | 如涉及,應提供。 |
涉及人的臨床研究倫理審查委員建設指南2019
關于發布《涉及人的臨床研究倫理審查委員會建設指南(2019版)》的通知
醫協會發[2019]18號
發布日期:20191029
各省級醫學倫理委員會、有關醫院:
為進一步規范臨床研究,加強倫理審查委員會的制度建設和能力建設,國家衛生健康委醫學倫理專家委員會辦公室、中國醫院協會組織專家研究制定了《涉及人的臨床研究倫理審查委員會建設指南(2019版)》,現予公布,請遵照執行。
附件:《涉及人的臨床研究倫理審查委員會建設指南(2019版)》
國家衛生健康委醫學倫理專家委員會辦公室
中國醫院協會
2019年10月29日
醫療器械注冊電子申報 信息化系統(eRPS)啟用
醫療器械注冊電子申報
信息化系統(eRPS)啟用說明
為落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),國家藥品監督管理局(以下簡稱國家藥監局)開展醫療器械注冊電子申報信息化系統(eRPS)的建設工作,研究借鑒國際醫療器械注冊電子申報經驗,實現醫療器械注冊申請的電子申報和在線審評。目前,eRPS系統已完成建設和測試工作,具備上線運行條件。按照《國務院關于在線政務服務的若干規定》(中華人民共和國國務院令 第716號),國家藥監局逐步推進醫療器械注冊政務服務平臺建設、安全保障和運營管理,做好從傳統的紙質資料提交到電子申報的過渡。
一、基本原則和范圍
(一)基本原則
1.信息保密。為提高電子申報資料的安全性,eRPS系統配套使用數字認證證書(Certificate Authority,CA)進行登錄、簽章、上傳、查詢、瀏覽等功能,防止申報資料、審評審批等信息泄露。
2.平穩有序。為保障eRPS系統穩步推進,國家藥監局將分批次、全方位地做好專題培訓,幫助行政相對人準確掌握電子申報資料要求,為行政相對人提供高效、便捷的政務服務。
3.持續完善。在eRPS系統啟動運行后,國家藥監局將不斷完善配套制度建設,積極收集各方意見,加強研判,持續完善eRPS系統,優化用戶使用體驗,做好與國家政務服務平臺對接工作。
(二)適用范圍
目前,eRPS系統業務范圍為國家藥監局醫療器械注冊事項,包括行政許可事項和公共服務事項。行政許可事項包括境內第三類和進口第二、三類醫療器械注冊、注冊變更、延續注冊以及第三類高風險醫療器械臨床試驗審批。公共服務事項包括醫療器械說明書更改告知、醫療器械注冊及許可事項變更復審、創新醫療器械特別審查等事項。
進口第一類醫療器械備案,注冊證及變更文件補辦,注冊證及變更文件糾錯,注冊證及變更文件自行注銷,自行撤回醫療器械注冊、注冊變更、延續注冊、復審,醫療器械注冊指定檢驗等事項暫不包含在eRPS系統業務范圍之內,仍沿用提交紙質資料的線下形式辦理。
國家藥監局醫療器械注冊電子政務服務事項列表詳見附表。
二、時間安排及資料形式
自2019年5月10日起,醫療器械注冊申請人、注冊人開始申領eRPS系統的CA,具體申領通知請關注國家藥監局醫療器械技術審評中心網站(www.cmde.org.cn)。
自2019年6月24日起,eRPS系統正式啟用,醫療器械注冊申請人、注冊人可按照《醫療器械注冊申請電子提交技術指南(試行)》以及相關通知的要求,在eRPS系統業務范圍內進行線上電子申報,無需提交紙質資料。
為保證醫療器械注冊工作的平穩有序開展,行政相對人仍可以選擇線下途徑進行紙質版注冊申報資料的提交。線下途徑設置過渡期,2019年10月31日前,注冊申請人、注冊人可以按照現行醫療器械、體外診斷試劑注冊申報資料要求提交紙質資料。2019年11月1日起,紙質資料應按照《醫療器械注冊申請電子提交技術指南(試行)》的要求提交。該指南參照國際醫療器械監管論壇(International Medical Device Regulators Forum,IMDRF)注冊申報規范(Regulated Product Submission,RPS)工作組形成的注冊申報資料目錄(Table of Contents, ToC)。無論采用哪種形式提交紙質資料,自eRPS系統啟用之日起,注冊申請人、注冊人均需按照《醫療器械注冊申請電子提交技術指南(試行)》要求同時準備一套符合RPS ToC形式的電子資料,置于所對應的文件夾層級結構中,儲存在U盤中與紙質資料一起同步提交至受理窗口,由受理窗口工作人員進行電子資料導入,生成可供技術審評使用的電子文檔。如注冊申請人、注冊人提交的電子資料不能生成符合技術審評要求的電子文檔,相應申請將不能正常受理。
三、有關要求
(一)簽章要求
按照《國務院關于在線政務服務的若干規定》,電子印章與實物印章具有同等法律效力,加蓋電子印章的電子材料合法有效,可以作為辦理政務服務事項的依據。行政相對人使用eRPS系統提交的電子申報資料應具有電子印章。電子印章是指境內醫療器械注冊申請人、注冊人(進口醫療器械生產企業代理人)專有的,基于可信密碼技術生成身份標識,以電子數據圖形表現的印章。持有CA的管理員可使用CA在電子申報資料中加蓋本企業的電子印章。進口產品的電子版原文資料除加蓋代理人的電子印章外還應提交紙質版公證文件的掃描件。
(二)CA申領要求
每個境內醫療器械注冊申請人、注冊人(進口醫療器械生產企業代理人)的組織機構代碼限申領1個CA,具備電子簽章、安全登錄、提交資料、查詢進度等全部功能。
(三)一致性要求
醫療器械注冊申請人、注冊人選擇線下途徑提交紙質資料時,需確保提交的注冊申報資料電子版本與紙質版本內容完全一致。在“符合性聲明”文件中出具一致性聲明,自我聲明所提交電子資料和紙質資料的一致性(進口產品還需由代理人出具)。在過渡期內按照現行醫療器械、體外診斷試劑注冊申報資料要求提交紙質資料的,注冊申請人、注冊人需確保電子資料與紙質資料內容完全一致,僅存在展現形式、存放順序的差異,并在“一致性聲明”中對差異情況作相關說明。過渡期后,注冊申請人、注冊人需確保電子資料與紙質資料內容完全一致,并在“一致性聲明”中自我聲明電子資料和紙質資料內容完全一致,不存在差異。
(四)注冊申報資料要求
eRPS系統將我國醫療器械注冊法規要求以RPS ToC的形式完整展示,該種形式的申報資料要求將最大程度方便行政相對人,提升我國醫療器械的研發水平,推動產業的健康發展,提升國際競爭力。醫療器械注冊申請人、注冊人使用eRPS系統進行電子提交的過程中應加深對我國注冊申報資料要求的理解,熟悉RPS ToC的通用規則,領會技術審評要求對醫療器械設計研發水平的引導作用,主動使用RPS ToC形式進行電子申報。
四、保障工作
國家藥監局按照國務院關于“互聯網+政務服務”行動的要求,穩步推進醫療器械審評審批服務便民化,做好系統上線前后的保障工作,注重收集外界評價,化解eRPS系統運行風險,最終構建方便快捷、公平普惠、優質高效的醫療器械注冊線上政務服務體系。
(一)eRPS系統啟動前
為保障eRPS系統能夠順利啟動,國家藥監局醫療器械技術審評中心(以下簡稱器審中心)將重點安排以下培訓工作:
1.公益培訓班。器審中心組建培訓講師隊伍分別面向省級藥品監督管理部門、醫療器械相關協會、學會、醫療器械生產企業開展電子申報專題培訓和操作演示,進而由省級藥品監督管理部門組織開展轄區內相關單位的培訓工作,由醫療器械相關協會、學會組織開展相關會員單位的培訓工作。
2.窗口預輔導。器審中心將設立服務窗口,為有需求的注冊申請人、注冊人提供面對面輔導,重點指導使用線下(紙質資料)提交途徑的注冊申請人、注冊人如何進行相關電子版資料的準備。具體聯系事宜請關注器審中心網站和微信公眾號。
(二)eRPS系統啟動后
1.針對性服務。為滿足行政相對人的提交需求,器審中心將通過CA領取階段的意愿調查,提前收集和掌握行政相對人的申報意愿,有針對性組織有關eRPS系統使用的培訓與指導,有效實現從紙質資料向電子資料的過渡。
2.全方位指導。eRPS系統建設影響范圍廣,改革力度大,與醫療器械行政相對人息息相關。為提供高質量的政務服務,器審中心在啟動后將開通電話答疑、遠程技術支持、發放操作手冊、錄制操作視頻等多種方式提供全方位、多途徑的指導和培訓。具體事宜可聯系器審中心。聯系方式如下:
工作時間:工作日9:00~11:30,13:30~16:30。
電話答疑:13391835251
技術支持QQ群:961097116
服務窗口:國家藥品監督管理局醫療器械技術審評中心業務大廳(北京市海淀區氣象路50號院1號樓)。
附表
國家藥監局醫療器械注冊電子政務
服務事項列表
|
序號 |
項目 |
子項 |
分項 |
|
1 |
境內醫療器械行政許可事項 |
境內第三類醫療器械注冊申請 |
境內第三類醫療器械注冊申請 |
|
2 |
境內第三類體外診斷試劑注冊申請 |
||
|
3 |
境內第三類 醫療器械注冊 變更申請 |
境內第三類醫療器械注冊登記事項變更申請 |
|
|
4 |
境內第三類醫療器械注冊許可事項變更申請 |
||
|
5 |
境內第三類體外診斷試劑注冊登記事項變更申請 |
||
|
6 |
境內第三類體外診斷試劑注冊許可事項變更申請 |
||
|
7 |
境內第三類 醫療器械 延續注冊申請 |
境內第三類醫療器械延續注冊申請 |
|
|
8 |
境內第三類體外診斷試劑延續注冊申請 |
||
|
9 |
境內第三類高風險醫療器械臨床試驗審批申請 |
||
|
10 |
進口醫療器械行政許可事項 |
進口第二、三類醫療器械注冊 申請 |
進口第二、三類醫療器械注冊申請 |
|
11 |
進口第二類體外診斷試劑注冊申請 |
||
|
12 |
進口第三類體外診斷試劑注冊申請 |
||
|
13 |
進口第二、三類醫療器械注冊 變更申請 |
進口第二、三類醫療器械注冊登記事項變更申請 |
|
|
14 |
進口第二、三類醫療器械注冊許可事項變更申請 |
||
|
15 |
進口醫療器械行政許可事項 |
進口第二、三類醫療器械注冊 變更申請 |
進口第二、三類體外診斷試劑注冊登記事項變更申請 |
|
16 |
進口第二、三類體外診斷試劑注冊許可事項變更申請 |
||
|
17 |
進口醫療器械延續注冊申請 |
進口第二、三類醫療器械延續注冊申請 |
|
|
18 |
進口第二、三類體外診斷試劑延續注冊申請 |
||
|
19 |
進口第三類高風險醫療器械臨床試驗審批申請 |
||
|
20 |
醫療器械公共服務事項 |
醫療器械說明書更改告知申請 |
|
|
21 |
醫療器械注冊及許可事項變更復審申請 |
||
|
22 |
創新醫療器械特別審查申請 |
||
醫療器械注冊申請電子提交技術指南(試行)
醫療器械注冊申請電子提交技術指南(試行)
通告 2019年 第29號
本指南文件的目的是指導注冊申請人、注冊人通過國家藥品監督管理局(以下簡稱國家藥監局)醫療器械注冊電子申報信息化系統(electronic Regulated Product Submission,eRPS系統)進行電子格式申報資料的準備、提交和電子申請事項的管理。本指南內容包括醫療器械注冊電子申報工作適用范圍、計算機系統要求、用戶安全性要求、電子申報資料格式要求、eRPS系統操作流程等內容,并以附件的形式明確了各類注冊相關申報事項電子申報資料的上傳目錄要求。
本指南文件依照我國醫療器械注冊流程和要求,參考國際醫療器械監管機構論壇(International Medical Device Regulators Forum,IMDRF)注冊申報規范(Regulated Product Submission,RPS)工作組于2019年1月發布的《IMDRF注冊申報資料目錄(ToC)的匯編與技術指南》進行制訂。
本指南文件規定了注冊申請人/注冊人提交電子注冊申報資料的一般性要求,請使用人員務必仔細閱讀,認真研究,未按照本指南所規定的格式要求制作的電子格式申報資料或未遵從相關的操作程序,可能會導致電子格式申報資料無法在eRPS系統中有效加載、上傳或對后續的審評審批工作造成影響。隨著相關法規規章調整、有關流程的改變以及信息化系統的不斷升級完善,本指南相關內容也將適時進行調整。
一、適用范圍
本指南適用于注冊申請人/注冊人采用eRPS系統在線提交事項申請、上傳電子格式申報資料(含補正資料)并進行各類申請相關的事務管理。注冊申請人/注冊人也可參照本指南以線下方式提交紙質申報資料。電子申報范圍為注冊申請人/注冊人向國家藥監局提交的醫療器械注冊政務服務事項,包括行政權力事項和公共服務事項,暫不包括進口一類醫療器械備案事項。行政權力事項包括境內第三類和進口第二、三類醫療器械注冊、注冊變更以及第三類高風險醫療器械臨床試驗審批。公共服務事項包括醫療器械說明書更改告知、醫療器械注冊/許可事項變更復審、創新醫療器械特別審查、注冊證/變更文件補辦、注冊證/變更文件糾錯、注冊證/變更文件自行注銷、自行撤回醫療器械注冊/注冊變更/延續注冊/復審、醫療器械指定注冊檢驗等事項。電子申報事項列表詳見附件1,eRPS系統開放事項請以國家藥監局通知為準。
二、系統登錄要求
eRPS系統為注冊申請人/注冊人提供兩種申報提交方式,用戶可使用網頁版或者客戶端進行登錄。網頁版eRPS系統的登錄入口為國家藥監局醫療器械技術審評中心(以下簡稱器審中心)官方網站首頁(https://www.cmde.org.cn)中的“申請人之窗”欄目,網址為http://erps.cmde.org.cn。登錄瀏覽器版本要求Internet Explorer 11及以上版本。非Internet Explorer瀏覽器支持及應用方法參考系統首頁上發布的操作手冊。客戶端eRPS系統需下載電子申報客戶端,安裝的硬件環境要求為1.5GHz以上處理器,內存空間建議為4G以上,硬盤空間建議為200G以上。安裝的操作系統要求為32位Windows 7(專業版,企業版,旗艦版) 或64位Windows 7(專業版,企業版,旗艦版)、Windows 10(專業版,企業版)且Microsoft .NET Framework 3.5 SP 1或更高版本。網絡環境要求為允許訪問器審中心網服務權限(erps.cmde.org.cn相關域名及相關端口)。若主機在AD域管理環境下,需要開放本地需要Windows本地操作系統初始安裝時默認權限。
為提高電子申報和信息傳輸的網絡安全等級,使用eRPS系統進行電子申報資料提交時應經數字認證證書(Certificate Authority,CA)的認證和簽章。本指南中的CA是基于密碼技術生成的一種電子文件,由第三方電子認證服務機構提供用于國家藥監局醫療器械政務服務平臺,符合《中華人民共和國電子簽名法》規定條件的可靠的電子數據,與手寫簽名或者蓋章具有同等法律效力。CA以USB KEY為介質,作為申請用戶登錄、上傳電子申報資料身份驗證憑證和電子簽章工具,能夠保證用戶身份的代表性、真實性和唯一性,只可用于國家藥監局各類醫療器械注冊申報事項的提交和管理,不可用于其他用途。CA申領企業需妥善保管好CA介質及用戶密碼,由CA持有人妥善保管,專人專用,不得轉借他人使用。因用戶原因導致CA遺失或損壞的,應由CA持有人承擔一切后果,并及時向國家藥監局提出注銷并重新進行申領。使用CA的單位應當建立相關管理制度,明確CA的保管、使用權限、用途、登記等要求。
三、電子注冊申報資料格式要求
(一)版面要求
為方便在線審評審批,本指南對于電子注冊申報資料的正文版面提出如下建議:中文字體建議選用宋體,英文字體建議選用Times New Roman。中文正文字號不小于四號字,表格文字不小于五號字。申報資料封面加粗三號字。申報資料目錄建議使用四號字,腳注五號字。英文不小于14號字。建議常規使用黑色字體。行間距離建議設為單倍。如頁面設置為縱向,則左邊距離不小于2.5cm、上邊距離不小于2cm、其他邊距不小于1cm;如頁面設置為橫向,上邊距離不小于2.5cm、右邊距離不小于2cm、其他邊距不小于1cm。左邊邊距應適宜裝訂。頁眉和頁腳信息應在上述頁邊距內顯示,保證文本在打印或裝訂中不丟失信息。
(二)文件格式要求
PDF格式作為電子注冊申報資料的文件格式,并建議盡可能使用由源文件(如WORD文件)轉化形成的PDF文件,而不是掃描后創建的PDF格式,因為這種方法允許可檢索文本在PDF中自動生成。建議Adobe Acrobat PDF軟件的版本在11或以下,如果版本超過11,則建議將PDF另存為11或以下的PDF文件。eRPS系統未對需要提交的電子文件的總容量進行限定,考慮到系統運行的順暢性,申報人應盡可能控制單個電子注冊申報PDF文件在100MB以內。對于大于100MB的文件或申報人認為有必要進行適當拆分時,應將其按照內容進行拆分,并通過文件名稱來反映原文件被拆分,如文件標題-part1、文件標題-part2等。
若注冊申報資料含無法訪問電子來源文件或需要第三方簽章文件,此部分資料可以是掃描后創建的PDF文件,掃描后創建PDF文件屬于紙質文件的數字轉化,建議參考中華人民共和國檔案行業標準《紙質檔案數字化技術規范》(DA/T 31—2017)有關要求。
(三)文件名稱
文件名稱長度受文件層級和電腦運行系統設置影響,建議單個電子注冊申報PDF文件名稱不超過64個字符(32個漢字)。應根據實際情況確保自定義文件和目錄名稱在上述控制長度范圍內,確保電子文檔的正常閱讀。文件命名應符合Windows文件命名規則。同一套電子注冊申報資料中的PDF文件不可重名,否則會導致重名的文件無法成功上傳。同一標題下需要上傳多份文件時,文件的命名方法應該確保文件按預期的順序進行顯示。
(四)書簽設置
對于頁數大于或等于10頁的文件建議設置內部的目錄,文件內部目錄由書簽自動生成,章節、小節、表格、圖片和附錄均建議作為書簽。通常,在文字處理器中使用標題、頁眉或樣式最容易創建標簽,其在文件被轉換成PDF格式后即可轉換成書簽。或者,也可以通過在最終的PDF文件中選擇文本并創建新標簽到此處以該文本做名稱創建書簽,或建立新的書簽并手動對其命名。書簽的層級最多為三層:1標題,1.1亞標題,1.1.1亞-亞標題。建議設置初次閱讀文件時用于打開“書簽和頁碼”的導航標簽。如果沒有書簽,設置“僅頁碼”導航標簽。
(五)頁碼編制
電子注冊申報資料頁碼應正確標識,保證通過頁碼可以定位相關信息。每個PDF文件均應設置頁碼。頁碼建議體現所在目錄編號信息,應清晰可辨,建議在文件下方正中位置。
(六)顯示完整性
為最大程度保證PDF文件的有效閱讀,PDF文件禁用由某種條件觸發才能實現的顯示或打印功能,禁用交互式表單和內部可執行代碼。為保證文件定位的方便快捷,同一份PDF文件內的超鏈接是允許的,但不應在不同文件之間使用超鏈接。PDF文件中如有超鏈接,注冊申請人/注冊人在上傳資料時有責任確保超鏈接在預覽模式下有效。
四、電子注冊申報資料目錄
IMDRF-RPS工作組于2014年發布國際注冊申報資料目錄即醫療器械電子文件結構(ToC),并于2018年進行修訂。此目錄內容包括6個章節,分別為第1章地區性監管信息、第2章申報產品綜述資料、第3章非臨床研究資料、第4章臨床研究資料、第5章說明書標簽和宣傳材料、第6A章質量管理體系程序、第6B章產品的質量管理體系相關信息。此目錄涵蓋了國際上通用和我國的地區性要求,因此我國作為IMDRF成員國之一,以RPS目錄為重要參考,建設形成我國電子注冊申報目錄樹。
為與國際先進醫療器械監管機制接軌,提高醫療器械在我國的注冊申報效率,通過信息化手段加快注冊審評審批速度,eRPS系統的電子提交目錄完整采納了RPS的相關目錄設置模式,以植入目錄樹的形式對電子注冊申報資料的上傳方式進行合理設置,明確了對各級目錄標題下提交的電子資料的內容要求,也便于審評人員的查閱及上市產品信息的歸檔。各個目錄標題的資料說明與《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》(國家食品藥品監督管理總局公告2014年第43號,以下簡稱43號公告)《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(國家食品藥品監督管理總局公告2014年第44號)的要求保持一致。
(一)目錄樹的自動生成
eRPS系統根據注冊申請人/注冊人選擇的注冊申報類型自動生成相應的目錄樹,目錄樹文件夾層級結構可通過eRPS系統客戶端進行下載。注冊申請人/注冊人在相應的目錄樹層級上傳電子注冊申報資料PDF文件。eRPS系統的目錄樹分為一級目錄(如CH1.01)、二級目錄(如CH2.4.1)、三級目錄(如CH3.5.05.08)、四級目錄(如CH3.5.05.08.1)、五級目錄(如 CH3.5.05.08.1.1),各級目錄的編碼和標題已按照RPS目錄和我國注冊申報資料要求進行鎖定,注冊申請人/注冊人可視資料情況選擇是否新增自建目錄(如CH3.5.05.08.1)來上傳相應的PDF文件。
(二)目錄類型
eRPS系統目錄可分為必須提交(R)、適用時提交(CR)和不需提交(NR)三種情形。R表示該目錄為強制上傳目錄,若此級目錄或下級目錄下無PDF版資料則無法成功提交申請。CR表示該目錄為適用情況下需要提交目錄,注冊申請人/注冊人根據注冊申報事項以及資料要求判斷是否適用,若根據相關法規要求或申報產品特性判斷為適用時,CR即表示需提交,若判斷為不適用時可不必在此級目錄下提交資料。NR表示該目錄下不需提交PDF文件。在資料說明中注明“該級標題無內容”的目錄應在下級目錄中上傳PDF資料。經受理審查或技術審評認為需要在某一CR目錄下上傳PDF資料時,注冊申請人/注冊人應在補充資料階段進行上傳。因此,在eRPS系統中除注明“該級標題無內容”的目錄和不適用的目錄,各級目錄均應上傳PDF文件。
本指南以附表形式和文件夾層級結構示例形式展現醫療器械和體外診斷試劑電子申報目錄樹(附件2—3),方便注冊申請人/注冊人提交電子申報資料。
五、eRPS系統注冊事項操作流程
(一)企業用戶注冊并登錄
首次使用eRPS系統的注冊申請人進行用戶注冊,輸入真實有效的信息后完成注冊,通過登錄賬號和密碼后進行CA申領。領取成功后再次登錄時注冊申請人需插入申領的CA介質(USB KEY)并選擇證書登錄方式,輸入密碼后方可進入eRPS系統。
(二)申報資料的電子簽章
注冊申請人使用本單位的CA通過eRPS系統客戶端進行本地文件的電子簽章。經簽章后的文件如發生修改,則在線提交時會顯示驗章失敗,導致此文件無法成功上傳。
(三)上傳電子申報資料
注冊申請人在eRPS系統填寫申請表并上傳部分申報資料的WORD版電子文件后即可進行電子注冊申報資料的關聯和上傳。
注冊申請人按照注冊申報和電子提交的相關要求,在系統自動生成的電子申報目錄標題下上傳PDF文件。如使用網頁版eRPS系統,注冊申請人上傳本地文件后關聯至相應的目錄標題下即可提交。如使用eRPS系統客戶端,注冊申請人將本地文件關聯電子申報目錄樹即可集中進行提交上傳。電子申報資料上傳前eRPS系統會進行自動驗章,驗章不成功則無法上傳。在文件上傳過程中如出現網絡中斷,網絡恢復后可繼續上傳正在提交的資料,實現斷點續傳,已上傳完畢的文檔無需再次上傳。經確認提交后的電子注冊申報資料無法修改且不可預覽、下載或更改。
(四)受理審查
器審中心工作人員自注冊申報資料簽收之日起在5個工作日內按照相應的受理標準要求對電子注冊申報資料進行在線審查。電子版資料符合受理要求的,工作人員向注冊申請人出具電子版受理通知書和繳費通知書,并進行短信和郵件提醒。不符合受理要求的由工作人員出具電子版補正材料通知書,列明補正材料意見并退回相關申請,eRPS系統保留前次申報信息,注冊申請人可在此基礎上進行完善,確認無誤后重復步驟(三)申請受理。若申報項目屬于不予受理的情形,工作人員向注冊申請人出具電子版不予受理通知書,列明不予受理的原因,終止此次申請流程。
(五)繳費流轉
電子注冊申報資料予以受理后,注冊申請人應按照繳費通知書要求進行繳費。經國家藥監局工作人員銀行對賬確認后。醫療器械產品電子注冊申報資料即可轉入技術審評階段,eRPS系統向注冊申請人發送短信和郵件提醒。
(六)審評審批
按照相關審評審批操作規范,具有某類產品的審評審批權限的工作人員可以在線閱讀eRPS系統中產品的電子注冊申報資料,實現隨時調閱、同步查看、批量預覽、備注標記等功能,并全程留痕。審評人員查閱電子版資料后,視情況出具電子版補正資料通知單,eRPS系統自動向注冊申請人發送短信和郵件提醒,提示產品處于發出補正通知狀態。注冊申請人可憑CA登錄eRPS系統,查詢審評審批進度。
(七)提交補充資料
注冊申請人在接收到補充資料通知單一年內在eRPS系統中“補充資料”模塊上傳電子版補充資料。注冊申請人在接收到補充資料通知單后,應嚴格按照補充通知單的要求準備相應的補充資料。為加強在補充資料階段主審人和注冊申請人的溝通交流,注冊事項的注冊申請人可通過eRPS系統對擬提交的完整補充資料提交一次預審查申請(自愿原則),主審人在規定時限內完成預審查并通過eRPS系統回復相關建議。補充資料預審查的提交不能代替正式的補充資料提交,主審人對補充資料提出的預審查結果不代表對于補充資料的正式確認。具體詳見器審中心預審查服務的通知。注冊申請人依據預審查意見完善補充資料,通過eRPS系統正式提交補充資料,申報項目進入補正后技術審評階段。
(八)查看審評審批進度
注冊申請人在申報全程可收到申報事項的審評審批進度的短信和郵件提醒,還可憑CA在eRPS系統查詢到審評審批進度和有關的電子文書。
附件:1.電子申報事項列表
2.eRPS系統電子申報目錄表
3. eRPS系統注冊電子申報目錄文件夾層級結構示例
創新產品人工晶狀體獲批
| 創新產品人工晶狀體獲批 |
|
2016年11月21日,國家食品藥品監督管理總局經審查,批準愛博諾德(北京)醫療科技有限公司的人工晶狀體注冊。 該產品為一件式后房人工晶狀體,可折疊,襻形為L形,主體和支撐部分均由丙烯酸乙酯等材料聚合而成,添加紫外線吸收劑和藍光吸收劑。該產品具有“后表面高凸”、“高次非球面”、“復雜面形獨立分離”、“邊緣等厚”和“具有肝素改性的疏水性丙烯酸酯材料”等特點,在國產人工晶狀體中尚屬首創,為國產器械在高端人工晶狀體領域的一大進步。適用于成年患者無晶體眼和原發性角膜散光摘除白內障后的視力矯正,旨在改善遠視力,減少殘余散光度并且減少對遠視力眼鏡的依賴。 食品藥品監督管理部門將繼續加強產品上市后監管,保護使用者的健康和安全。 |
| 2016年11月24日 發布 |
醫療器械分類目錄研討會在京召開
| 醫療器械分類目錄研討會在京召開 |
|
近日,國家食品藥品監督管理總局在京召開醫療器械分類目錄修訂研討會。研討會分三個專場,分別聽取醫療機構和高等院校的專家學者、國內外企業代表以及食品藥品監管人員的意見建議,進一步完善修訂版醫療器械分類目錄內容。國家食品藥品監督管理總局副局長焦紅出席研討會。 經過研討,參會專家一致認為,分類目錄順應科學規律、適應產業創新發展、貼近臨床應用需求。醫療器械分類目錄的制修訂是一項長期性工作,應建立分類目錄動態調整機制,相關領域專家將積極為醫療器械分類目錄調整貢獻智慧。 醫療器械分類工作是醫療器械風險管理的基礎,也是醫療器械審評審批制度改革的重要組成部分。目前,分類目錄修訂工作已進入關鍵階段,總局在做好政策法規支撐的同時,充分整合調動社會資源,建立分類技術委員會和專業組,積極聽取各方面意見建議,不斷完善目錄。在下一步工作中,總局將繼續發揮統籌協調作用,并結合臨床使用和不良事件監測情況,及時對醫療器械的風險進行分析評價,合理劃分管理類別,更好地滿足公眾用械需求。 |
| 2016年11月22日 發布 |
創新醫療器械特別審批申請審查結果公示 11號
| 創新醫療器械特別審批申請審查結果公示 |
| 2016年第11號 |
|
依據國家食品藥品監督管理總局《創新醫療器械特別審批程序(試行)》(食藥監械管〔2014〕13號)要求,創新醫療器械審查辦公室組織有關專家對創新醫療器械特別審批申請進行了審查,擬同意以下申請項目進入特別審批程序,現予以公示。 產品名稱:腦血栓取出裝置 申 請 人:江蘇尼科醫療器械有限公司 公示時間:2016年11月22日至2016年12月5日 公示期內,任何單位和個人有異議的,可以書面、電話、郵件等方式向我中心綜合業務處反映。 聯 系 人:徐亮 電 話:010-68390674 傳 真:010-68390777 電子郵箱:xuliang@cmde.org.cn 地 址:北京市西城區車公莊大街9號五棟大樓B3座301室 郵 編:100044 |
|
國家食品藥品監督管理總局 醫療器械技術審評中心 2016年11月22日 |
創新醫療器械特別審批申請審查結果公示 10號
| 創新醫療器械特別審批申請審查結果公示 |
| 2016年第10號 |
|
依據國家食品藥品監督管理總局《創新醫療器械特別審批程序(試行)》(食藥監械管〔2014〕13號)要求,創新醫療器械審查辦公室組織有關專家對創新醫療器械特別審批申請進行了審查,擬同意以下申請項目進入特別審批程序,現予以公示。
1.產品名稱:骶神經刺激系統 申 請 人:杭州承諾醫療科技有限公司 2.產品名稱:全降解聚合物基體藥物(雷帕霉素)洗脫支架系統 申 請 人:樂普(北京)醫療器械股份有限公司 3.產品名稱:血管內斷層成像導管 申 請 人:南京沃福曼醫療科技有限公司 4.產品名稱:全自動化學發光免疫分析儀 申 請 人:北京聯眾泰克科技有限公司 5.產品名稱:無導線心臟起搏器及系統 申 請 人:St.Jude Medical 6.產品名稱:恒溫擴增多段磁導核酸分析儀 申 請 人:杭州優思達生物技術有限公司 7.產品名稱:活化CD4細胞三磷酸腺苷(ATP)檢測試劑盒(化學發光法) 申 請 人:上海云澤生物科技有限公司
公示時間:2016年11月15日至2016年11月28日 公示期內,任何單位和個人有異議的,可以書面、電話、郵件等方式向我中心綜合業務處反映。 聯 系 人:徐亮 電話:010-68390674 傳真:010-68390777 電子郵箱:xuliang@cmde.org.cn 地址:北京市西城區車公莊大街9號五棟大樓B3座301室 郵編:100044 |
|
國家食品藥品監督管理總局 醫療器械技術審評中心 2016年11月15日 |
關于《醫療器械優先審批程序》的說明
| 關于《醫療器械優先審批程序》的說明 |
|
一、制定程序的背景 2014年3月31日,國務院發布了新修訂的《醫療器械監督管理條例》,其中規定:國家鼓勵醫療器械的研究與創新,發揮市場機制的作用,促進醫療器械新技術的推廣和應用,推動醫療器械產業的發展。2014年2月7日,食品藥品監管總局發布了《創新醫療器械特別審批程序(試行)》,對創新醫療器械設置特別審批通道,對鼓勵醫療器械創新,促進醫療器械新技術的推廣和應用,推動醫療器械產業發展起到了積極作用。 為進一步滿足人民群眾日益增長的使用醫療器械的臨床需求,引導和鼓勵醫療器械產業創新發展,國家先后出臺多項鼓勵支持產業發展政策。如《中國制造2025》(國發〔2015〕28號)、《國家中長期科學和技術發展規劃綱要》(2006-2020年)、《健康中國2030規劃綱要》,以及科技部發布的國家科技重大專項或重點研發計劃,都將醫療器械創新發展作為推動衛生與健康領域科技創新的重要內容。2015年,國務院發布了《關于改革藥品醫療器械審評審批制度的意見》(國發[2015]44號),2016年國務院辦公廳發布了《深化醫藥衛生體制改革2016年重點工作任務的通知》(國辦發〔2016〕26號),進一步明確鼓勵醫療器械研究和創制,對臨床急需醫療器械、兒童、老年人等特殊人群以及罕見病用醫療器械設置審評審批專門通道。 為進一步深化醫療器械審評審批改革,保障醫療器械臨床使用需求,在目前已實施的《創新醫療器械特別審批程序》和應對突發公共衛生事件的《醫療器械應急審批程序》的基礎上,有必要對治療罕見病、惡性腫瘤、老年病、兒童專用、臨床急需以及列入國家科技重大專項或重點研發計劃等情形的醫療器械,制定醫療器械優先審批程序,設置優先審批通道。 二、程序的主要內容 2016年10月25日,國家食品藥品監督管理總局發布《醫療器械優先審批程序》,將于2017年1月1日起施行。 本程序共17條,包括目的和依據、優先審批的范圍、申請、審核、公示程序、優先辦理要求、實施日期等內容。 (一)優先審批的范圍 實施優先審批的醫療器械范圍為:一是診斷或治療罕見病、惡性腫瘤且具有明顯臨床優勢的醫療器械、診斷或治療老年人特有和多發疾病且目前尚無有效診斷或治療手段的醫療器械、專用于兒童且具有明顯臨床優勢的醫療器械、臨床急需且在我國尚無同品種產品獲準注冊的醫療器械。二是列入國家科技重大專項或國家重點研發計劃的醫療器械。 由于可能會有其他情形醫療器械需要優先審批,本程序設置了“其他應當優先審批的醫療器械。”對于其他應當優先審批的醫療器械,食品藥品監管總局根據各方面情況和意見,組織專家審查后確定是否予以優先審批。 (二)優先審批程序 對注冊申請人提出的優先審批申請,屬于列入國家科技重大專項或國家重點研發計劃的產品,申請人應提交相關證明文件,經總局器審中心審核、公示后,無疑義的實施優先辦理。 對于診斷或治療特殊疾病或臨床急需的產品,以及“其他應當優先審批的醫療器械”,由總局器審中心每個月集中組織專家論證,經公示后,無疑義的實施優先辦理。 對確定予以優先審批的項目總局器審中心按照接收時間單獨排序,優先進行技術審評,省級食品藥品監督管理部門優先安排醫療器械注冊質量管理體系核查,總局優先進行行政審批。 (三)關于罕見病、老年人特有和多發疾病、臨床急需等情況的認定 罕見病、老年人特有和多發疾病、臨床急需等情況,是指我國疾病衛生領域的現實狀況,會隨著我國社會和科技發展、疾病診療水平、公民健康情況而變化。本程序實施過程中將通過組織臨床專家審查的方式研究確定產品是否予以優先審批。 (四)本程序與醫療器械應急審批程序、創新醫療器械特別審批程序的關系 應急審批程序是為保證應對突發公共衛生事件的需要,在規定時限內快速完成醫療器械注冊審批相關工作。創新醫療器械特別審批程序是針對具有核心技術發明專利、國際領先、國內首創、具有顯著的臨床應用價值等情形的醫療器械,采取按照早期介入、專人負責、加強溝通、優先辦理的原則予以支持。本程序與應急審批程序、創新審批程序的目的和內容不同。 本程序與創新醫療器械特別審批程序并行運行,申請人可以根據產品具體情況選擇適合的程序進行申請。已經按照《醫療器械應急審批程序》、《創新醫療器械特別審批程序(試行)》進行審批的注冊申請項目,不執行本程序。 |
| 2016年10月26日 發布 |
印發食藥監管系統法治宣傳教育第七個五年計劃
|
總局印發全國食品藥品監管系統法治宣傳教育 第七個五年規劃(2016—2020年) |
|
為貫徹落實《中共中央、國務院轉發〈中央宣傳部、司法部關于在公民中開展法治宣傳教育的第七個五年規劃〉的通知》要求,進一步做好新時期食品藥品監管法治宣傳教育工作,近日,食品藥品監管總局印發了《全國食品藥品監管系統法治宣傳教育第七個五年規劃(2016—2020年)》(以下簡稱《規劃》)。 《規劃》提出,全國食品藥品監管系統法治宣傳教育第七個五年規劃的指導思想是全面貫徹黨的十八大和十八屆三中、四中、五中全會精神,深入貫徹習近平總書記系列重要講話精神,堅持“四個全面”戰略布局,堅持創新、協調、綠色、開放、共享的發展理念,按照全面推進依法治國的新要求,堅持法治宣傳教育與法治實踐活動相結合,完善法治宣傳教育工作機制,深入開展食品藥品安全法治宣傳教育,扎實推進食品藥品安全依法治理和法治創建,進一步提高食品藥品監管法治化水平,為“十三五”時期食品藥品監管事業發展創造良好的法治環境,切實保障公眾飲食用藥安全。 《規劃》指出,全國食品藥品監管系統法治宣傳教育第七個五年規劃的主要目標是法治宣傳教育機制要進一步完善,法治宣傳教育形式要進一步豐富,法治宣傳教育效果要進一步提升。 《規劃》明確,全國食品藥品監管系統法治宣傳教育第七個五年規劃的工作原則是堅持圍繞中心、服務大局,堅持依靠群眾、服務群眾,堅持學用結合、普治并舉。 《規劃》提出,全國食品藥品監管系統法治宣傳教育第七個五年規劃是深入學習宣傳習近平總書記關于全面依法治國的重要論述,突出學習宣傳憲法,深入學習宣傳中國特色社會主義法律體系,深入學習宣傳食品藥品監管法律法規,推進食品藥品安全法治文化建設。 《規劃》指出,食品藥品安全法治宣傳教育的對象是食品藥品監管部門及其行政執法人員、食品藥品生產經營企業及其從業者、廣大消費者和青少年,重點是各級食品藥品監管部門領導干部。要以增強法治思維、提高依法決策能力為重點,加強各級領導干部法治宣傳教育,以增強專業法律知識、提高執法能力為重點,加強食品藥品行政執法人員法治宣傳教育,以增強企業主體責任和誠信守法意識為重點,加強食品藥品生產經營企業及其從業人員法治宣傳教育,以引導消費者掌握基本法律知識、依法維權為重點,加大對廣大消費者及青少年食品藥品安全知識的普及力度。 《規劃》提出,全國食品藥品監管系統法治宣傳教育第七個五年規劃工作措施是健全食品藥品安全法治宣傳教育機制,落實食品藥品安全普法責任制,推進食品藥品安全法治宣傳教育創新,積極推動食品藥品安全法治教育公益宣傳。 《規劃》明確,全國食品藥品監管系統法治宣傳教育第七個五年規劃工作步驟是從2016年開始實施,到2020年結束。普法規劃階段為2016年,組織實施階段為2017—2020年;2020年為檢查驗收階段。 《規劃》要求,各級食品藥品監管部門要切實加強組織領導,提供必要保障條件,強化考核評估工作,嚴格按照《規劃》所確定的要求,保質保量,按期完成各項宣傳教育工作。 |
| 2016年09月27日 發布 |
醫療器械工藝用水質量管理指南的通告
|
國家食品藥品監督管理總局關于發布醫療器械 工藝用水質量管理指南的通告 |
|||
| (2016年第14號) | |||
|
|||
|
食品藥品監管總局 2016年1月26日 |
